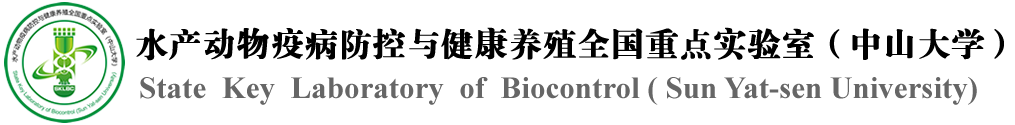【研究进展】黄盛丰/徐安龙教授团队解释蛋白结构域重排如何推动IL-17信号通路的起源及其在鱼虾等物种中的功能模式多样化
IL-17是目前唯一可追溯至无脊椎动物的白介素家族。哺乳动物的IL-17是一类功能多样的促炎因子,参与黏膜修复与防御,连接天然与适应性免疫,其中IL-17A还是Th17细胞的主效因子。但哺乳动物IL-17的独立激活能力较弱,主要起协同其它细胞因子作用,被称为免疫的“主指挥者(chief orchestrator)”[1]。线虫的IL-17则以另一种模式工作,即作由为神经元分泌的神经调质,调控感官、行为、寿命和免疫[2, 3]。目前尚不清楚为何IL-17的功能模式在不同物种之间差异如此之大。此外,在大部分门纲中,特别是在软体动物、节肢动物(昆虫和虾蟹等)和鱼类这前三大门纲中,IL-17通路的结构与功能研究还非常欠缺。因此无法推断是什么机制推动了IL-17通路的功能多样化。揭示这一机制将有助干预、调控甚至重设IL-17通路的功能与作用。
2024年4月29日,黄盛丰/徐安龙教授团队取得最新研究进展,相关成果以“The IL-17 pathway intertwines with neurotrophin and TLR/IL-1R pathways since its domain shuffling origin”为题,发表在PNAS上。研究采用高灵敏从头搜索方法,从十三个真后生动物门纲中发掘出许多不易发现的IL-17配体、受体和接头蛋白,揭示了IL-17通路序列与结构的高度多样性(图1A)。研究还系统梳理了IL-17通路、TLR/IL-1R通路和NT-RTK(神经营养因子-受体酪氨酸激酶)通路之间的结构与互作关系(图1B)。

图1:(A)配体IL-17、受体IL-17R和接头蛋白CIKS在不同动物门纲中的分布、组成和结构差异;(B)IL-17通路、TLR/IL-1通路和NT-RTK(神经营养因子-受体酪氨酸激酶)通路之间的结构对比和互作关系。
在上述基础上,结合功能证据,研究揭示IL-17通路起源于真后生动物祖先的一次结构域重排事件。在该事件中,Trunk-Torso通路(一种经典NT-RTK通路)提供配体和受体胞外区,TLR/IL-1R通路提供受体胞内区和接头蛋白,重组形成了全新的IL-17通路。有意思的是,与大多数独立进化的新通路不同,IL-17通路在后续演化中竟然与它的两条供体通路一直保持交互作用(crosstalk)。推测这种作用成为驱动IL-17通路结构、组成和功能模式多样化的重要力量(图2)。

图2:IL-17通路的起源与演化模型。TLR/IL-1R通路和Trunk-Torso通路通过蛋白结构域重排创造了IL-17通路,之后三条通路保持交互作用,经历一系列结构与组成变化,并形成现今动物门纲之间的功能差异。
例如,在昆虫中,Trunk和PTTH均能结合RTK受体Torso,其中Trunk-Torso是调控昆虫胚胎发育的经典途径[4],PTTH-Torso则是调控昆虫变态和蜕皮的重要通路[5]。出乎意料的是,研究发现PTTH在系统发育上更接近IL-17而非Trunk,而且体外实验显示一些昆虫的PTTH能够与IL-17受体相互作用,因此提示昆虫IL-17通路和Trunk-Torso通路依然存在交互作用(图2-3)。值得一提的是,研究还发现,虾蟹等甲壳动物特有的神经肽CFSH,同样在系统发育上接近IL-17,同样在体外实验中与IL-17受体相互作用(图2-3)。前人的研究发现CFSH由虾蟹眼部神经分泌细胞产生,能够诱导性别分化和雌性性腺发育[6, 7]。因此,CFSH可能代表了一种全新的IL-17功能模式。
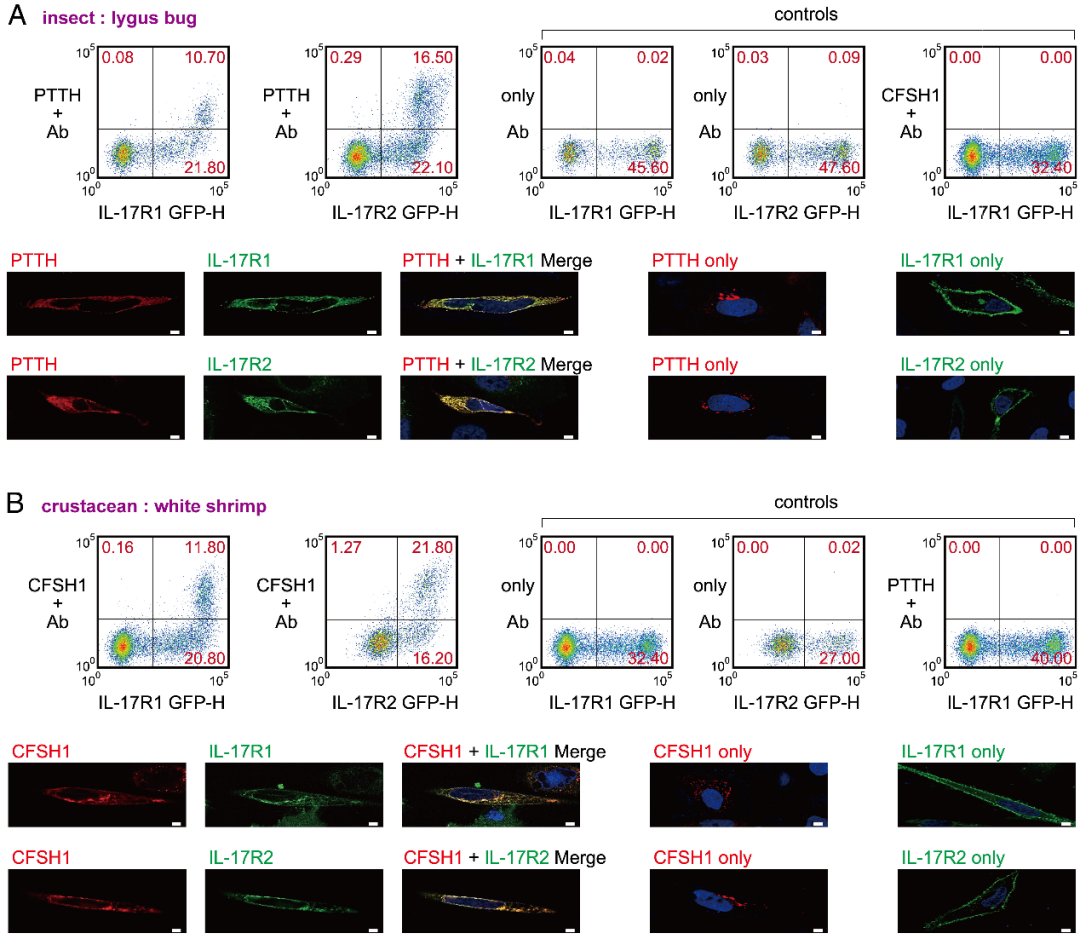
图3:免疫荧光共定位和流式细胞分析显示节肢动物(昆虫蝽和甲壳类对虾)IL-17通路和Trunk-Torso通路的能够发生相互作用。
进一步的研究证实,IL-17通路和TLR/IL-1R通路在斑马鱼和文昌鱼中也存在广泛的交互作用。但出乎意料的是,研究发现,斑马鱼的接头蛋白、鲤科鱼类全部三个接头蛋白、乃至包括哺乳动物在内所有脊椎动物的接头蛋白,均丢失了死亡结构域。丢失死亡结构域导致IL-17通路的自身激活能力大幅下降,甚至不足原先百分之一。这解释了哺乳动物IL-17的已知功能模式——自身信号强度不足以作为“主激活者”,因此转为协同其它免疫通路的“主指挥者”。研究进一步推测,脊椎动物的祖先IL-17通路能够忍受死亡结构域的丢失,是因为与TLR/IL-1R通路的广泛交互作用放松了针对IL-17通路的净化选择压力。更有意思的是,研究将死亡结构域人为复原给接头蛋白,发现不但可让IL-17通路的自身激活能力恢复到祖先强度,还能够有效地提升斑马鱼仔鱼的抗菌能力(图4)。
图4:(A-B)斑马鱼和文昌鱼IL-17通路的野生型接头蛋白和复原死亡结构域的重组接头蛋白的信号激活能力比较;(C)表达复原了死亡结构域的接头蛋白可有效提升斑马鱼胚胎的NF-κB激活水平以及仔鱼的抗菌能力。
有理论认为涉及胞间通讯和胞外基质的蛋白结构域重排,是驱动生物多细胞化、复杂化和多样化的核心力量[8]。研究对IL-17通路的探索,揭示了结构域重排及其与供体通路的交互作用,主导了该通路在不门纲之间的功能模式差异化,因此不但为上述理论提供了很好的案例,还为养殖动物的抗病抗逆育种以及人类的医药健康提供了重要的候选靶点。
该研究于2024年4月29日发表在PNAS上,生命科学学院博士后陈生晖为第一作者,黄盛丰教授和徐安龙教授为共同通讯作者,水产动物疫病防控与健康养殖全国重点实验室为第一完成单位。本研究在国家自然科学基金委、科技部和广东省的科研项目资助下完成。
原文链接:https://doi.org/10.1073/pnas.2400903121