【研究进展】张锐教授团队揭示影响新冠病毒传染性和抗原性的RNA编辑热点位点
2019年底,由SARS-CoV-2引发的新冠疫情给人类带来了一场灾难。截止到2022年2月9日,全球累计确诊人数为397,259,234,累计死亡人数为5,750,868。作为一种正链RNA病毒,高变异性使得SARS-CoV-2极易产生“超级变异株”,例如:Alapha、Beta、Gamma、Delta、Lambda和Omicron等,这给新冠疫苗及治疗方法的开发带来了极大挑战。因此,解析SARS-CoV-2变异的驱动力以及突变积累的规则变得尤为重要。ADAR介导的A-to-I RNA编辑可以对RNA的碱基进行编辑,而关于SARS-CoV-2中是否存在A-to-I RNA编辑以及A-to-I RNA编辑对病毒的影响还未有一个系统的研究。对此,我室张锐教授团队展开了深入的研究,开发了一种高特异性的RNA病毒A-to-I RNA编辑位点鉴定的生物信息学分析方法。
传统的RNA编辑定位方法主要通过对同一样本的DNA和RNA测序结果比对鉴定RNA特有的变异,主要是A-to-I RNA编辑位点。由于RNA病毒仅以RNA形式存在,使得科研人员无法利用之前的方法鉴定SARS-CoV-2基因组中的A-to-I RNA编辑位点。利用ADAR编辑RNA的聚类特性和正义链RNA病毒复制过程中编辑造成的特殊突变模式(图1A),张锐教授团队建立了特异性地鉴定RNA病毒基因组中A-to-I RNA编辑位点的生物信息学分析方法(图1B)。与动物中的A-to-I RNA编辑方式不同,正义链RNA病毒基因组中存在着“one-step”及“two-step”两种不同的A-to-I RNA编辑方式(图1C)。
对上万份SARS-CoV-2基因组的测序数据(图2A)进行收集及分析,团队在SARS-CoV-2中鉴定了8977个A-to-I RNA编辑位点(图2B)。最为重要的是,研究鉴定出SARS-CoV-2基因组中的A-to-I RNA编辑存在“hotspot”现象(图2B),即有些位点会在不同个体中频繁的被编辑。进一步的研究表明,一些A-to-I RNA编辑位点可以通过改变Spike蛋白的氨基酸序列调控血清以及抗体对Spike蛋白与ACE2的结合作用(图2C和2D)。最后,张锐教授团队还发现,A-to-I RNA编辑促进SARS-CoV-2在人群中的进化,并且发现有数十个编辑位点跟新近毒株中关键位点突变一致,暗示这些毒株可能是通过RNA编辑获得关键突变。
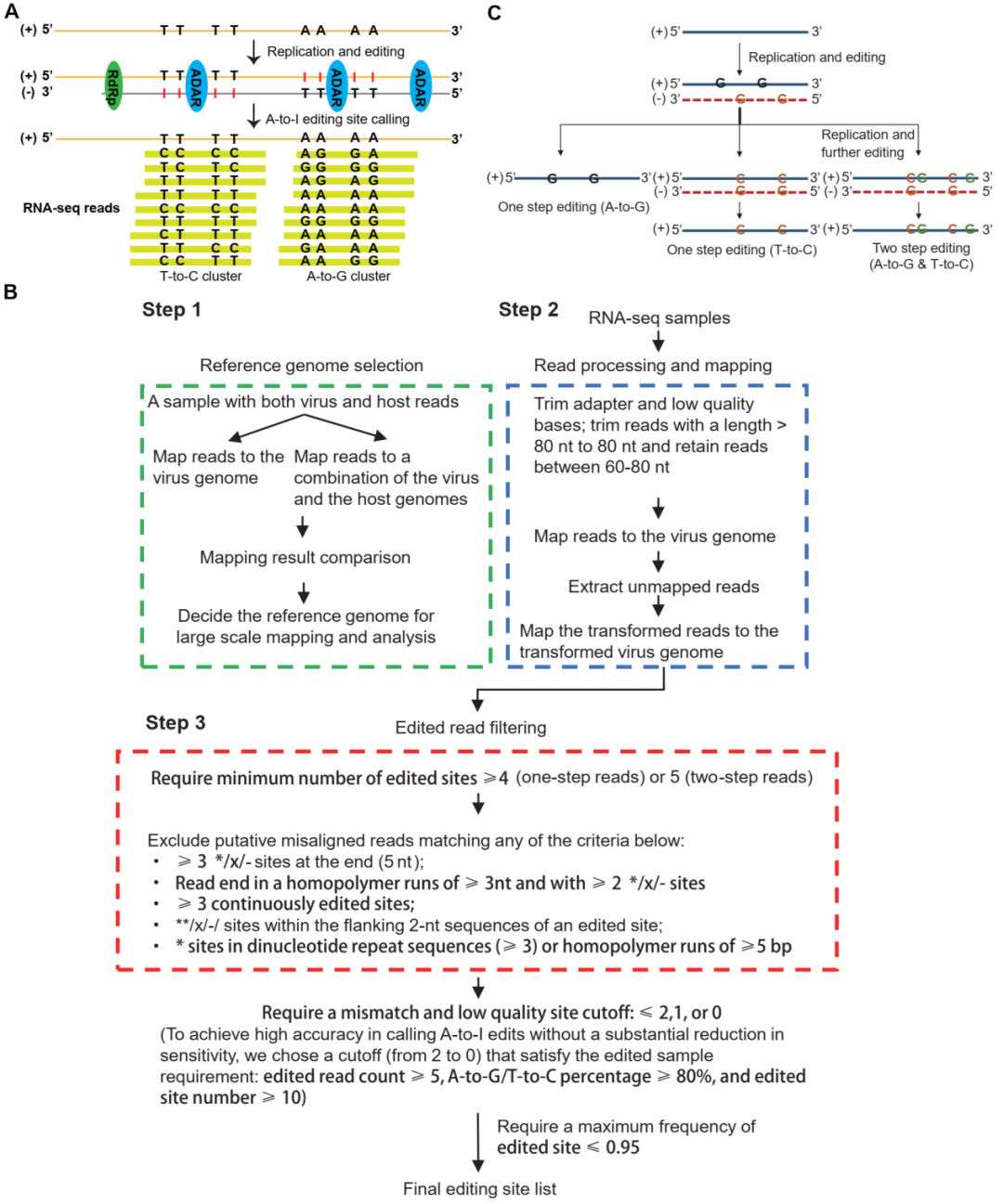
图1. RNA病毒特异性A-to-I RNA编辑位点鉴定流程。(A) SARS-CoV-2基因组中A-to-I RNA编辑位点鉴定示意图;(B) RNA病毒特异性A-to-I RNA编辑位点发现流程;(C) SARS-CoV-2基因组中one-step及two-step RNA编辑现象示意图。

图2. SARS-CoV-2基因组中A-to-I RNA编辑图谱和位于spike蛋白的影响病毒传染性和抗原性的RNA编辑位点。(A) 研究使用的SARS-CoV-2数据信息;(B) SARS-CoV-2基因组中A-to-I RNA编辑位点分布;(C) Spike蛋白上影响ACE2结合和中和抗体结合的A-to-I RNA编辑位点;(D) 实验验证A-to-I RNA编辑位点影响中和抗体跟Spike蛋白的结合力。
最后,团队还利用其新开发的方法对SARS、MERS、Zika及登革热等正义链RNA病毒进行A-to-I RNA编辑位点鉴定分析,并在上述RNA病毒中检测到了A-to-I RNA编辑位点。
综上所述,张锐教授研究团队关于SARS-CoV-2中A-to-I RNA编辑的研究工作证明A-to-I RNA编辑是促进SARS-CoV-2基因组变异的驱动力之一。研究发现的RNA编辑热点位点,特别是位于spike蛋白的可能增强传染性和抗原性的位点,可以整合在目前的SARS-CoV-2 mRNA疫苗的开发及新冠治疗方法的研究中,用于提前抵御可能出现的有害突变株。另外,团队对SARS、MERS、Zika及登革热等RNA病毒中A-to-I RNA编辑的研究,也为其它RNA病毒mRNA疫苗的类似开发工作提供了基础。
2022年3月2日,研究成果以“Virus-specific editing identification approach reveals the landscape of A-to-I editing and its impacts on SARS-CoV-2 characteristics and evolution”为题,发表于Nucleic Acids Research。在该研究中,研究人员开发了一种高特异性的RNA病毒A-to-I RNA编辑位点鉴定的生物信息学分析方法;通过对上万份SARS-CoV-2基因组的测序数据进行分析,证明了SARS-CoV-2通过劫持宿主细胞中的ADAR1 p150对自身基因组进行RNA编辑;定位了SARS-CoV-2基因组中位于spike蛋白的影响病毒传染性和抗原性的RNA编辑热点位点,为mRNA疫苗的设计和优化提供了重要的指导价值。
张锐教授团队的特聘副研究员宋玉龙博士、博士生何修驹以及博士后杨文兵博士为该论文的并列第一作者,张锐教授及宋玉龙博士为通讯作者,中山大学为唯一单位。另外,生命科学学院的崔隽教授及唐恬教授对本研究提供了帮助。该研究得到了广东省重大科技专项、国家自然科学基金、中国博士后科学基金特别资助等项目的支持。
原文链接:https://doi.org/10.1093/nar/gkac120。