【研究进展】谢伟教授团队取得对鸟苷脱氨酶 GSDA 的结构解析及其催化机制研究新进展
嘌呤是核糖核酸 (RNA) 与脱氧核糖核酸 (DNA) 的重要组成部分,主要以嘌呤核苷酸的形式存在。嘌呤衍生物是许多生物分子的重要组成部分,为机体提供能量,且能调节生物的代谢过程。核苷酸的生物合成及代谢对包括植物在内的所有生物体的生长发育具有重要意义。
核苷脱氨酶通过消除环外氨基来催化核苷的水解。植物中的鸟苷脱氨酶 GSDA 特异性地将鸟苷催化脱氨生成黄苷,黄苷进一步转化为黄嘌呤,成为嘌呤代谢和氮循环的关键中间体。2013 年,Claus-Peter Witte 等首次对拟南芥鸟苷脱氨酶 (Arabidopsis thaliana guanosine deaminase, AtGSDA) 进行了遗传鉴定。GSDA 在拟南芥中普遍表达,并且在 gsda 突变体的相应组织中鸟苷显著积累。据报道,gsda 基因的突变会使得植物对黑暗的敏感性增强,且光化学效率降低,进而延迟植物的生长发育。GSDA 的底物特异性很高,只能催化鸟苷或 2'-脱氧鸟苷。GSDA 和鸟嘌呤脱氨酶 GDA 同属于 CDA 超家族,但是 GSAD 只存在植物中,且两者的底物和催化机制不尽相同。目前,关于 GDA 的结构和生化性质的研究很多,但对 GSDA 的研究相对较少,对其底物识别、催化机制以及生理功能的了解更少。
中山大学生命科学学院谢伟教授团队长期从事蛋白质结构与功能关系与酶催化的分子机制研究。近期,团队研究解析了AtGSDA 脱底物,与底物/产物结合的复合物的结构 (PDB 7DBF,7DC9,7DCA)。通过结构比较,发现在反应前后,活性中心的关键残基的位置和取向几乎相同,但存在一些细微的结构重排。特别是,黄苷不再与 Glu108 或 Cys107 接触。O2 和 O3' 分别通过与 Cys110 和 Asp140 的氨基相互作用而添加额外的氢键。此外,Asn69 与黄苷的 N7 失去相互作用(图 1a, b)。有趣的是,产物的嘌呤环发生了约 45 度的旋转,并且催化水分子消失。由于旋转,核糖环的位置也有轻微的改变(图 1c)。酶的 C 末端的一段 loop 富含大部分极性残基,因此使得 C 端十分灵活柔韧。在 apo-AtGSDA 中,二聚体的一个单体较另一个单体的 C 端 4 个残基不可见。一旦与配体结合,C 端就会改变其构象。与配体结合的酶的 C 端回环并指向活性位点,并且两条链的末端残基 (Tyr185) 的电子云密度清晰可见(图 1d)。

图 1. AtGSDA 反应前后的结构变化
接下来团队对介导酶和底物分子相互作用的残基进行了定点诱变。为了确保突变体的结构完整性,团队首先通过热迁移实验 (TSA) 来检查突变体的熔解温度(Tm 值)(图 2a)。随后通过薄层色谱 (TLC) 的形式进行脱氨基活性测定。F53L、L119W、E82Q 可能存在蛋白质折叠问题,这些突变几乎完全丧失了酶的催化能力,而 N69A 突变使得活性降低到 ~70%。相比之下,Y185F,R121A,R121A/Y185F,Y185E,Y185K及WT-SF的活性似乎没有受到很大影响,但 K181和 R183 截短体的活性几乎完全丧失(图 2b)。考虑到 TLC 方法对酶活性特征的不敏感且不易定量,团队利用两步耦联反应,采用紫外-可见分光光谱法进行酶学表征。WT 的 kcat/KM 为 8.4 mM-1sec-1,而 N69A 的 kcat/KM 约降低到 WT 的1/20,E82Q、F53L 和 L119W 则没有检测到活性。可见 L119W,F53L,E82Q 对于酶发挥催化活性至关重要。此外,Y185F 的活性低于 WT 的 20 %,185K 和 Y185E 突变体与 Y185F 的活性没有显著差异,R121A 的 kcat/KM 值降至 WT 的 1/4 以下,而双突变体 R121A / Y185F 的活性降至 WT 的 1/20。截短体R183 的活性也变得非常弱,K181 则几乎失活,这可能与催化中心的暴露有关。这些结果表明,AtGSDA 的 C 末端在酶催化反应中起着重要作用。
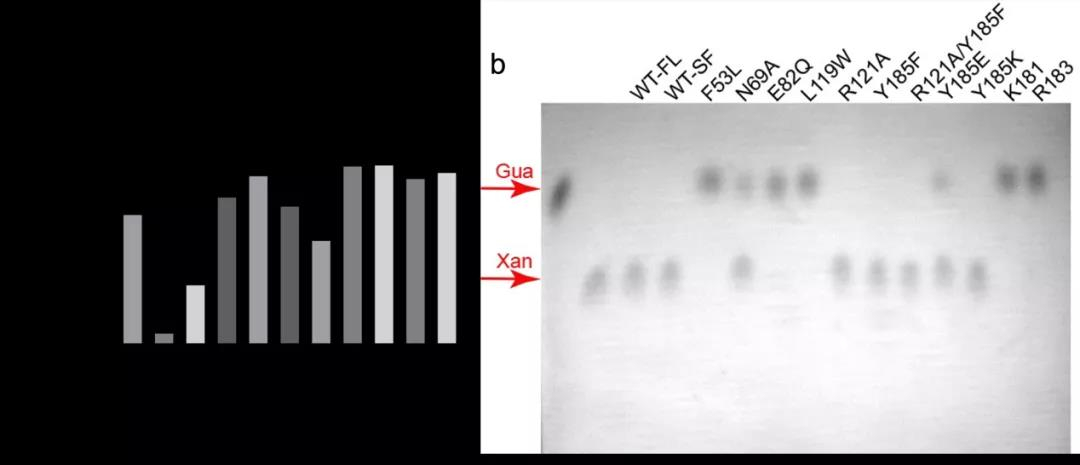
图 2. AtGSDA 野生型和突变体蛋白的热稳定性及脱氨酶活性的检测
团队利用 TLC 初步探究了 AtGSDA 蛋白是否对除鸟苷外的其它类似物也具有催化活性。令人意外的是,2’-氧甲基鸟苷 (2´-O-methylxanthoisne,2´-O-mG) 和 AtGSDA 蛋白孵育后迁移位置有所改变,2´-O-mG 疑似被催化发生了反应,所以 2´-O-mG 可能为 AtGSDA 蛋白的潜在底物。为了进一步验证 AtGSDA 蛋白是否对鸟苷衍生物具有催化活性,团队进行了 LC-MS 质谱实验。AtGSDA 与 2´-O-mG 的反应体系经过质谱检测出现了产物 2´-O-methylxanthoisne 的峰(图 3)。2´-O-mG 的生成证明 AtGSDA 蛋白的确对 2´-O-mG 具有催化活性。

图 3. LC-MS 检测 2´-O-methylxanthoisne 可作为 AtGSDA 的潜在底物
团队解析了 AtGSDA 的脱底物,结合底物以及结合产物三种不同状态下的高分辨率结构,每一种都代表不同的催化阶段。基于结构和生化分析,作者提出了 AtGSDA 的催化途径:(a) 在apo状态下,活性中心的锌离子与 Cys110、Cys113、His80 和一个水分子进行配位;(b) 底物鸟苷结合并诱导酶 C 末端 loop 回环并封闭到底物结合位点上,而酶整体结合保持完整;(c) Glu82 激活催化水,进而攻击底物的 C2 并形成四面体中间体;(d) 酶发生翻转,伴随着黄苷嘌呤环的旋转,产物生成后被释放,另一水分子重新和酶结合形成配位,有利于酶进入下一轮催化反应(图 4)。

图 4. AtGSDA 假定的催化途径
综上所述,在该项研究中,作者首次解析了 GSDA 游离和配体结合形式的高分辨率的晶体结构。确定了配体(底物和产物)与酶之间的结合模式,并通过脱氨活性测定进行验证,解释了 GSDA 的底物特异性识别机制。在脱氨反应过程中,酶和底物都发生一定的构象变化,酶 C 末端环对于 GSDA 催化至关重要。尽管 GSDA 对鸟苷具有很高的底物特异性,但作者发现额外的鸟苷衍生物也可用作酶的底物。根据结构和生化结果,最终提出了酶动力学和催化途径的模型。此项研究工作提供了对参与嘌呤代谢的此类重要酶的深入了解,并可能有助于开发基于脱氨酶的基因编辑工具。
2021年9月28日,谢伟教授团队在学术期刊Chemical Communications发表题为“The C-terminal loop of Arabidopsis thaliana guanosine deaminase is essential to catalysis”的研究论文。该研究首次解析了 GSDA 结合底物前后的一系列高分辨率结构,并对其底物特异性和催化机制进行了阐释。谢伟教授为该论文通讯作者,博士后贾倩为本文第一作者,有害生物控制与资源利用国家重点实验室为第一完成单位。该研究得到了国家自然科学基金,广东省基金和博士后基金的支持。
原文链接:https://pubs.rsc.org/en/content/articlelanding/2021/CC/D1CC03042F