【研究进展】徐安龙教授团队发现m⁶A修饰蛋白WTAP负调控抗病毒免疫的新机制
N6-甲基腺嘌呤(N6-methyladenosine,m6A)是真核生物mRNA上较为普遍的化学修饰,由甲基转移酶复合物METTL3/METTL14/WTAP等催化形成,能影响mRNA的剪接、稳定性、转位、翻译,从而在多种生理及病理过程中扮演重要角色。IFN-I及Jak-STAT信号通路作为宿主抵御病毒感染、维持机体稳态的重要防线,其信号调控网络受到极大关注。目前发现在转录、转录后修饰、翻译及翻译后修饰水平均存在复杂多样的调控机制来维持IFN-I信号的动态平衡。最近的研究发现m6A不仅是宿主免疫细胞区分自我和非自我的重要机制,也可能是调控宿主抗病毒能力及病毒免疫逃避的一种重要手段。因此,研究m⁶A如何调控IFN-I及Jak-STAT信号通路从而影响宿主抗病毒免疫能力及病毒的免疫逃逸具有重要的意义。
徐安龙教授团队首先发现宿主细胞的抗病毒免疫反应被激活后,m⁶A甲基书写复合体(Writer)成员WTAP的蛋白丰度发生显著下调,该下调由蛋白酶体降解途径介导。随后发现WTAP蛋白的降解可以负调控宿主抗病毒免疫反应。通过对IFN-I信号通路中关键的受体和接头蛋白进行筛选,发现干扰素调节因子3(IRF3)和干扰素α/β受体亚基1(IFNAR1)的蛋白丰度在敲低WTAP后明显减少。进一步的生物信息学预测,发现在IRF3的5’ UTR以及 IFNAR1的3’ UTR区域存在可信度较高的m6A修饰位点。敲低WTAP后,这些位点的m⁶A修饰水平显著降低。最后,该研究确定WTAP的降解会导致IRF3 mRNA的翻译抑制以及IFNAR1 mRNA的降解加速,从而在病毒感染后,通过降低IRF3及IFNAR1的蛋白产量实现对I型干扰素信号的负反馈调控,维持了机体的稳态(图1)。因此,该研究不但从转录后修饰角度反映了机体免疫调控网络的精密性和复杂度,也说明了m⁶A甲基化修饰在机体生命活动中的重要性和普遍性。
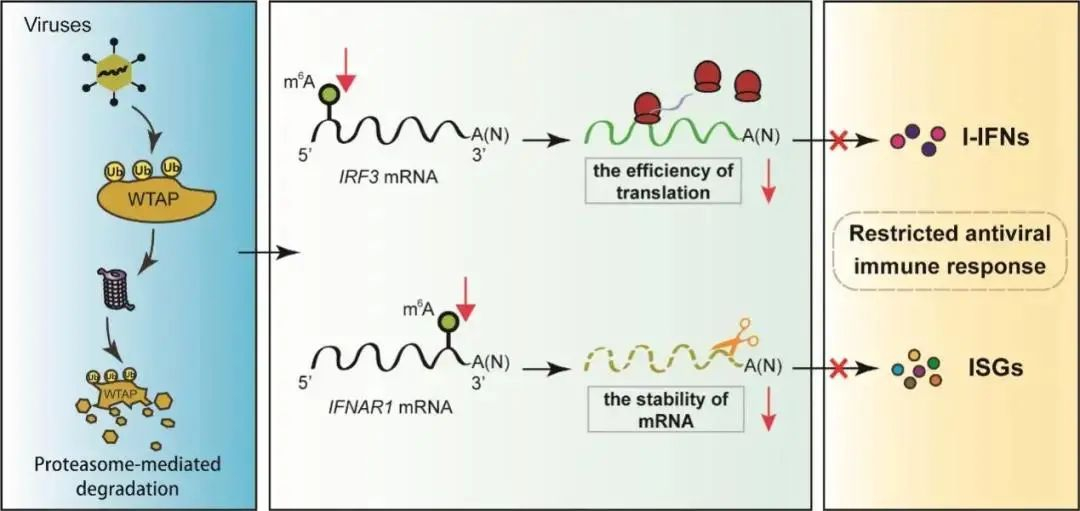
图1. 病毒感染后蛋白酶体介导WTAP的降解降低了IRF3和IFNAR1的m⁶A修饰以及随后的蛋白输出,从而抑制了IFN-I介导的抗病毒免疫反应。
近日,成果以Degradation of WTAP Blocks Antiviral Responses by Reducing the m6A Levels of IRF3 and IFNAR1 mRNA 为题,发表在EMBO Reports上,文章揭示了病毒感染后RNA甲基化转移酶复合体成员WTAP通过m⁶A甲基化修饰负调控抗病毒免疫的新机制。该工作在中山大学生命科学学院完成。徐安龙教授与元少春教授为论文的共同通讯作者,博士后葛永及博士生凌韬为该论文的共同第一作者,有害生物控制与资源利用国家重点实验室为第一完成单位。
原文链接:https://www.embopress.org/doi/full/10.15252/embr.202052101